EGFR-TKI耐药怎么办?赛沃替尼联合治疗达PR,患者实现58个月PFS
该病例为65岁女性,最初诊断为右肺上叶前段腺癌(T4N1M0,IIIb期),EGFR 19del突变。经过吉非替尼治疗后,肿瘤进展为IV期,并出现EGFR继发耐药,基因检测为EGFR 19del伴MET扩增。患者入组了MET抑制剂赛沃替尼临床试验,予以赛沃替尼联合吉非替尼联合治疗至今。最佳疗效为部分缓解(PR),截止到2022年1月,患者目前无进展生存期(PFS)达58个月,持续随访中。该病例由南京医科大学第一附属医院许佳丽教授提供,并邀请南京医科大学第一附属医院郭人花教授点评。
病例简介
图1 吉非替尼治疗后,疗效达PR
图2 吉非替尼治疗8个月后,胸部CT检查显示右肺上叶病灶增大,头颅MR检查显示右侧顶骨局部溶骨性骨质破坏伴强化
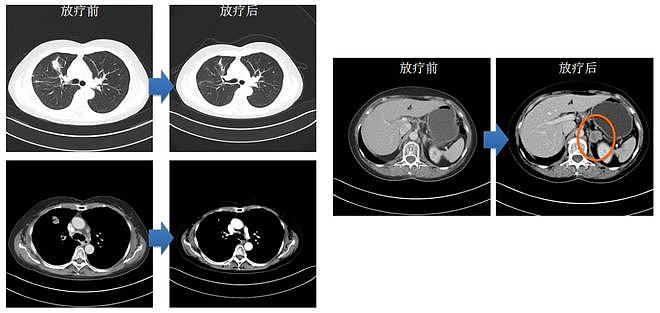
图3 放疗+吉非替尼治疗后,CT检查结果提示肺部病灶明显变小,左肾上腺结节明显增大,考虑转移;MR检查结果颅骨病灶SD
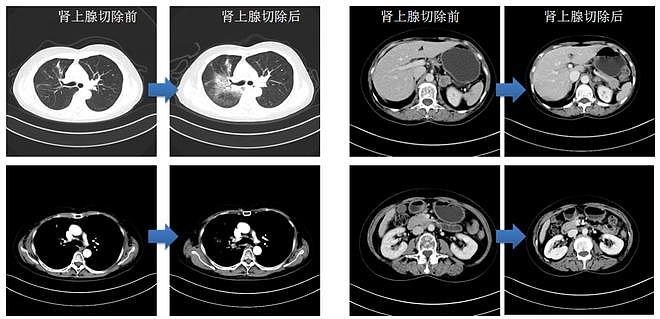
图4 肾上腺切除后,CT检查结果提示肺部SD,肾上腺病灶缩小
图5 吉非替尼联合化疗后:疗效评价SD
图6 赛沃替尼+吉非替尼治疗后:疗效评价PR
该患者就诊时为为无法手术切除的IIIb期、EGFR 19del突变型肺癌。经EGFR-TKI吉非替尼治疗8个月后,肺病病灶增大并发生颅骨转移,肿瘤进展为IV期。抗癌管家-康爱管家,我们一起抗癌,治愈癌症不是梦。经放疗后,患者头痛症状缓解,并继续口服吉非替尼治疗2个月。患者肺部病灶明显变小,但发生肾上腺转移,故给予左肾上腺切除术。患者的肾上腺组织NGS检测结果为EGFR 19del、cMET扩增。
1个月后,该患者出现了肾上腺转移灶,给予吉非替尼联合培美曲塞治疗。但仅仅2个多月后,左肾上腺结节就增大。基因检测结果仍为EGFR 19 del、MET扩增。
由于之前有研究提示,EGFR 19 del伴cMET扩增的患者可能从双靶治疗中获益,因此患者入组临床试验。予以“赛沃替尼 600mg po qd+吉非替尼 250mg po qd”治疗至今。最佳疗效为PR,截止到2022年1月,患者目前PFS达58个月,持续随访中。
病例提供专家
许佳丽教授:NSCLC患者经EGFR-TKI治疗耐药后,应检测MET突变
在我国,肺癌发病率和死亡率均位居恶性肿瘤首位。最新数据显示,2020年,中国有超过81万人新患肺癌,超过71万人死于肺癌[1],严重威胁人民群众的健康。近年来,随着分子生物学技术的快速发展及不同肿瘤驱动基因的发现,非小细胞肺癌(NSCLC)的治疗已进入了靶向治疗时代。目前,已发现NSCLC发生的驱动基因异常包括EGFR、KRAS、ALK等[2]。
随着EGFR-TKI和ALK-TKI等靶向药物的应用,NSCLC患者生存时间得到了延长,但几乎不可避免的是肿瘤通常会产生耐药性。EGFR-TKI获得性耐药突变十分复杂,包括EGFR二次突变,例如T790M突变;旁路激活,例如MET基因扩增、HER2扩增或突变、ALK基因融合、ROS1基因融合、AXL基因扩增等;也可能由NSCLC转化为小细胞肺癌(SCLC)[3]。EGFR-TKI获得性耐药突变的复杂性提示了基因检测的重要性。
本病例中的患者初期为EGFR突变,经一代EGFR-TKI治疗两线后,发生继发耐药,继发耐药的突变类型关系着患者后续的治疗。经NGS检测,患者为EGFR 19 del、MET扩增双基因突变。抗癌管家-康爱管家,我们一起抗癌,治愈癌症不是梦。经多学科讨论后,患者入组临床试验,采用MET抑制剂赛沃替尼600mg po qd联合吉非替尼250mg po qd的双靶策略进行治疗至今。最佳疗效为PR,截止到2022年1月,患者目前PFS达58个月,持续随访中。
NSCLC精准治疗的前提是精准诊断,除了明确要求的检测项目,包括EGFR、ROS1、ALK等,在有必要的情况下,可以将基因检测的靶点范围铺得更广。从该病例来看,EGFR-TKI耐药后,MET扩增有必要成为必检的项目。
专家点评
郭人花教授:EGFR突变合并MET扩增,可使用MET-TKI联合EGFR-TKI
MET基因是一种原癌基因,位于7号染色体长臂。MET扩增在NSCLC中发生率较低,被认为是EGFR-TKI的耐药机制之一[2]。约20%的EGFR-TKI继发性耐药患者出现MET扩增。据统计,MET扩增者约占对第一代EGFR-TKI耐药患者的5%,因此有研究者认为MET扩增是第三代EGFR-TKIs潜在的耐药机制之一[4]。针对MET扩增后的治疗,目前国内尚没有药物获批,以化疗为主,但是可以入组临床试验,使用MET抑制剂进行治疗。
本病例中的患者为EGFR 19 del、MET扩增双基因突变,针对这种突变类型,EGFR和MET通路的双靶抑制可能带来协同治疗获益。在针对吉非替尼耐药细胞的分析中发现[5],MET也可以磷酸化HER3,导致PI3K-Akt通路的激活。因此,单独使用EGFR或MET抑制剂都不足以使HER3-PI3K-Akt轴失活或耐失速细胞生长。联合使用EGFR和MET抑制剂可以阻止耐药细胞中HER3的磷酸化和Akt的激活,从而降低细胞存活率。
既往针对MET位点的研究大多针对MET原发突变,但在国际多中心TATTON研究中[6],研究者针对既往使用EGFR-TKI治疗后出现MET扩增的局部晚期或转移性NSCLC患者的治疗进行了探索,填补了使用EGFR-TKI后出现进展且合并MET耐药突变的人群的空白。
TATTON研究扩展队列方面,患者入组后被随机分为B组和D组,B组又划分为B1、B2和B3组,除了B1组既往使用过第三代奥希替尼治疗,抗癌管家-康爱管家,我们一起抗癌,治愈癌症不是梦。B2和B3组都未经第三代EGFR-TKI治疗,B2组为耐药后合并MET扩增但T790M为阴性,B3组为耐药后合并MET扩增和T790M突变。研究设计基本做到了对第一、二、三代EGFR-TKI治疗耐药出现MET扩增情况的全覆盖。
研究结果显示,PFS和客观缓解率(ORR)均显示了非常好的结果。整个B组患者的PFS达到7.6个月,整体ORR达到49%。
此外,2021年ORCHARD研究[7]公布了奥希替尼耐药后,MET基因变异组疗效数据。其中17例患者全部为检出MET扩增,接受奥希替尼80 mg QD+赛沃替尼300/600 mg QD治疗,7例患者经研究者评估达到PR,ORR为41%,且全部达到缓解的患者均在继续接受治疗。研究将继续按计划入组至约30例患者,并在2022年第4季度公布最终疗效数据。
该患者采用EGFR-TKI和MET-TKI赛沃替尼双靶治疗至今,最佳疗效为PR,目前已获得长达58个月的PFS,仍在持续随访中。通过这一病例,可以看到,针对EGFR-TKI继发耐药后MET扩增NSCLC患者,已经从过去的束手无策发展到现在的有迹可循。目前,MET抑制剂赛沃替尼已经获批MET14号外显子跳跃突变适应症,针对MET扩增患者治疗的临床研究也正在进行当中,相信未来MET扩增患者会有更好的治疗选择。
本文转自肺癌康复圈(由“抗癌管家网站-康爱管家”转载分享)













 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


